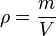Inledning:
Dagens experiment är ett applikationsexperiment vilket är ett experimentet där
vi med hjälp av vår hypotes från föregående experiment ska försöka lösa ett problem. Alltså kan vi använda E=c*m*DT för att lösa ett problem? Det problem som ska undersökas är vilken ämne en okänd metallbit är. För att undersöka detta problem tog vi reda på metallens specifika värmekapacitet som sedan jämfördes med en formelsamling. För att med säkerhet kunna bestämma vilket ämne metallen var beräknades även metallens densitet.
vi med hjälp av vår hypotes från föregående experiment ska försöka lösa ett problem. Alltså kan vi använda E=c*m*DT för att lösa ett problem? Det problem som ska undersökas är vilken ämne en okänd metallbit är. För att undersöka detta problem tog vi reda på metallens specifika värmekapacitet som sedan jämfördes med en formelsamling. För att med säkerhet kunna bestämma vilket ämne metallen var beräknades även metallens densitet.
Metod & Material:
Följande metod genomfördes för att ta reda på metallens
värmekapacitet:
En termosflaska fylldes med 470,85g vatten och dess temperatu
r och massa antecknades. Metallen vägdes och dess massa antecknades. Därefter värmdes den okända metallbiten till 100*C i en separat bägare med hjälp av en doppvärmare. När metallen hade nått den önskade temperaturen fördes den med försiktighet ner i termosen med hjälp av en tång. Det skedde en konstant omrörning av vattnet tills temperaturen på vattnet hade hamnat i jämvikt. Sluttemperaturen antecknades.
 |
| Bild1. Den okända metallen. |
r och massa antecknades. Metallen vägdes och dess massa antecknades. Därefter värmdes den okända metallbiten till 100*C i en separat bägare med hjälp av en doppvärmare. När metallen hade nått den önskade temperaturen fördes den med försiktighet ner i termosen med hjälp av en tång. Det skedde en konstant omrörning av vattnet tills temperaturen på vattnet hade hamnat i jämvikt. Sluttemperaturen antecknades.
För att få ett mer exakt värde på värmekapaciteten
beräknades även termosens värmekapacitet. Den beräknades genom att först mäta
temperaturen på termosen, samt fylla en bägare med 0,470kg vatten. Vattnets
starttemperatur antecknades, och vattnet fördes därefter ned i termosen. När
temperaturen hade hamnat i jämvikt antecknades sluttemperaturen.
För att beräkna densiteten på metallbiten användes formeln: P=m/V. Metallen vägdes på en
våg och massan antecknades och dess volym mättes med linjal. För att beräkna
metallens volym användes formeln för att beräkna volym på en cylinder.
Vattnets specifika värmekapacitet=4000J/Kg*K
C,vattnets universella specifika värmekapacitet= 4190J/Kg*K
Vattnets starttemperatur: 12,1°C
Termosens temperatur: 20,2°C
Vattnets sluttemperatur: 12,5°C
C,vattnets universella specifika värmekapacitet= 4190J/Kg*K
Vattnets starttemperatur: 12,1°C
Termosens temperatur: 20,2°C
Vattnets sluttemperatur: 12,5°C
Termosens värmekapacitet med det C värde som vi fick fram i
observationsexperimentet, C=4000J/Kg*K:
Med hjälp av energiprincipen, kan den värme som termosen
mottar(E1) likställas med den värme som vattnet avger (E2)
och följande formel fås fram:
E1 = E2
C= C*m* ΔT2/ ΔT1
Sedan stoppas de kända
värdena in i funktionen:
Termosens värmekapacitet med det universella talet på vattnets specifika värmekapacitet vilket är C=4190J/Kg*K:
På samma sätt som jag räknade ut termosens värmekapacitet
räknades metallens specifika värmekapacitet. Metallen avger värme (E2) som termosen och vattnet tar emot (E1) .
Resultaten från metallens specifika värmekapacitet:
C, Vattnets specifika värmekapacitet=4000J/Kg*K
Cu ,vattnets universella specifika värmekapacitet= 4190J/Kg*K
Cu ,vattnets universella specifika värmekapacitet= 4190J/Kg*K
m2, metallens massa=0,279kg
mv, vattnets massa=0,470kg
ΔT1, vattnets temperaturförändring= 10,7°C-9,3°C
ΔT2, metallens temperaturförändring= 100°C -10,7°C
mv, vattnets massa=0,470kg
ΔT1, vattnets temperaturförändring= 10,7°C-9,3°C
ΔT2, metallens temperaturförändring= 100°C -10,7°C
Energiprincipen ger:
E2=E1
E2=E1
C*m2* ΔT2= (C+Cv*mv) ΔT1 =
C=(C+Cv*mv) ΔT1 / m2* ΔT2
Med de kända värdena insatta, där C=4190, ger:
C=(C+Cv*mv) ΔT1 / m2* ΔT2
Med de kända värdena insatta, där C=4190, ger:
C*0,279(100-10,7)=102,3+4190*0,470(10,7-9,3)
C= 102,3+4190*0,470(10,7-9,3)/0,279(100-10,7)J/kg*K
C=116,4 J/kg*K=0,12 KJ/kg*K
Med de kända värdena insatta där C=4000, ger:
C=116,14 J/kg*K=0,12KJ/kg
Metallens densitet:
Diskussion:
Ur resultaten kan metallens specifika värmekapacitet avläsas
som 0,12KJ/kg*K. Detta kan avläsas i en formelsamling och följande ämnen har en
specifik värmekapacitet som liknar de resultat som vi fick fram: Bly (0,13 KJ/kg*K),
Platina (0,13 KJ/kg*K), Tantal(0,14 KJ/kg*K), Uran(0,12 KJ/kg*K), Vismut (0,12 KJ/kg*K)
och Volfram (0,13 KJ/kg*K). Det ämne som är mest troligt utifrån metallens
utseende är bly. Men för att öka säkerheten på resultatet kan vi jämföra med
den andra undersökningen. Metallens densitet var 11,35g/cm3. Ur
formelsamlingen kan blys densitet avläsas som 11,3 g/cm3 vilket
överensstämmer med vårt resultat.
Densiteten på metallen skiljde sig något från blys densitet.
För att öka sannolikheten på resultaten skulle man kunna varit mer noggrann vid
mätning av metallen. Dessutom skulle man kunna beräknat dess densitet genom att
göra som vi gjort i ett tidigare experiment. Genom att beräkna volymökningen
när man stoppar ner metallen i en volym vatten.
Varför resultatet på värmekapaciteten inte stämde överens
exakt med blys specifika värmekapacitet beror på flertal faktorer. När vi lyfte
metallen från bägaren till termosen avgavs värme från metallen till tången och omgivningen för att jämna ut temperaturskillnaden (termodynamikens andra huvudsats). För att minska energiförlusterna skulle en bomullstråd
använts för att överföra metallen från bägaren till termosen samt skulle vi ha
varit snabbare med själva överföringen av metallen. Vi använde oss av en termos istället för en bägare då en termos isolerar värmen mycket bättre och på så sätt minskas energiförlusterna. Vi skulle använt ett lock för att minska värmeförlusterna. Dessutom var inte vattnet rumstempererat
utan vattnet var 9,3grader. Detta kan ha haft en inverkan på resultaten, då
enligt termodynamikens andra huvudsats, försöker luften att utjämna den
skillnad som finns mellan det kalla vattnet och det rumstempererade luften. Därför
skulle rumstempererat vatten använts istället.
Som i tidigare experiment kan omrörningen av vattnet haft en
inverkan på resultaten. Då värmen centreras i mitten av bägaren om man inte rör
om vattnet. Vi försökte att hålla en konstant omrörning. Med bättre utrustning
och material skulle ett mer sanningsenligt resultat fåtts.
Det C värde som vi fick fram från de tidigare experimenten
är också en felkälla. Då värdet skiljer sig något från det universella värdet
på vattnets specifika värmekapacitet. Därför räknades det med båda C värdena. Ur
resultatet kan man avläsa att dessa två värden endast skiljer sig med
decimaler.
Troligtvis har dessa felkällor haft en subtil påverkan på
våra resultat då resultaten stämde nästan överens med både metallens bly
densitet och värmekapacitet.
Slutsats:
Metallen är bly.